Servicios Especializados
- Banco de Sangre
- Laboratorio de Biología Molecular
- Maternidad
- Medicina Genética
- Medicina Nuclear
- Sala de Infusiones
- Centro de Entrenamiento Internacional RCP
Clínicas Especializadas
Guía de Soluciones de Salud (Blog)
Por: Rosales Bravo, Luis Guillermo 1 y Torrealba Acosta, Gabriel 2.
1 Departamento de Neurología. Hospital México. Caja Costarricense de Seguro Social. San José, Costa Rica.
2 Departamento de Neurología. Hospital del Trauma. Instituto Nacional de Seguros. San José, Costa Rica.
Resumen: La trombosis de senos venosos durales (TSVD) es una emergencia neurológica poco común y potencialmente mortal. Su incidencia anual se estima entre 2-7 casos por millón de habitantes. La oclusión repentina de un seno venoso por n trombo causa un incremento agudo de la presión intracraneal provocando hipertensión intracraneal. Debido a la ruptura de venas corticales tanto hemorragia cerebral parenquimatosa como hemorragia subaracnoidea pueden estar presentes en el TAC de cerebro sin contraste. Su diagnóstico puede ser un reto. Una alta sospecha clínica se requiere pa a su diagnóstico temprano. Actualmente con el uso de la venografía por TAC o por RM su diagnóstico es menos difícil. La mayoría de los pacientes se recuperan sin ninguna lesión neurológica residual. En TVSD el inicio rápido de la anticoagulación es mandatoria para repermeabilizar el seno venoso ocluido. Ni la hemorragia cerebral parenquimatosa ni la hemorragia subaracnoidea contraindican la anticoagulación. Se describen las principales características demográficas, factores de riesgo, halla gos clínicos, características neuroradiológicas, tratamiento y evolución de 10 pacientes consecutivos con el di gnóstico de TVSD en un único hospital público de Costa Rica.
Palabras clave: trombosis de seno venoso craneal, hemorragia intracerebral, tomografía computarizada por rayos X, anticoagulantes. Fuente: Decs.
Abreviaturas
CVST: cerebral venous sinus thrombosis
MR: magnetic resonance
MRV: magnetic resonance venography
CT: computed tomography
CTV: computed tomography venography
VKA: vitamin K antagonist
mRS: modified Rankin scale
LMWH: low molecular weight heparin
INTRODUCCIÓN
La trombosis de senos venosos cerebrales es una emergencia poco común y potencialmente mortal. TSVD representa aproximadamente el 0,5-1% de todos los derrames cerebrales [1]. La incidencia anual se estima en 2-7 casos / millón de habitantes. Las mujeres jóvenes y de mediana edad son las más afectadas, la mayoría de las cuales tienen entre 20 y 40 años [2].
La oclusión repentina por un coágulo en un seno venoso provoca un aumento agudo de la presión intracraneal y puede conducir a la hipertensión intracraneal. Con mayor frecuencia, el paciente tendrá dolor de cabeza, pero también podría haber déficits neurológicos, convulsiones y conciencia deprimida. Debido a la ruptura de las venas corticales, tanto la hemorragia parenquimatosa cerebral como la subaracnoidal podrían estar presentes en la tomografía computarizada inicial sin contraste [3, 4]. Sin embargo, en aproximadamente el 10% de los pacientes, la tomografía computarizada sin contraste podría ser normal [3].
En esos casos, el diagnóstico es ciertamente más desafiante y requiere una mayor sospecha clínica para un diagnóstico temprano. Además, la implementación de técnicas de neuroimagen como la VTC y la RMV contribuyen al enfoque del diagnóstico [5]. Finalmente, la rápida implementación del tratamiento anticoagulante permite a la mayoría de los pacientes tener un buen pronóstico y recuperación sin ningún daño neurológico.
SUJETOS Y MÉTODOS
Métodos
Entre enero y diciembre se analizaron pacientes consecutivos de 2013 con un diagnóstico de TSVD según los informes de VTC. Información sobre el sexo, la edad, los factores de riesgo, la presentación clínica y los hallazgos en el examen neurológico, el tiempo transcurrido entre la manifestación inicial y el diagnóstico definitivo, los hallazgos principales en la TC cerebral sin contraste y VTC, tratamiento anticoagulante, terapia anticonvulsiva, complicaciones intrahospitalarias, resultados clínicos y la mortalidad hospitalaria de los pacientes, también fueron recolectados.
Sujetos
Se incluyeron todos los pacientes con un diagnóstico de TSVD que ingresaron en los departamentos de Neurología, Medicina Interna y la Unidad de Cuidados Intensivos del Hospital México en San José, Costa Rica. Este estudio fue aprobado por el Comité Institucional de Ética Científica de la Caja Costarricense de Seguro Social (número de protocolo CECI-CCSS R017-SABI-00114).
Protocolo de Adquisiciones CTV
Para la adquisición de las imágenes de CTV en el Hospital México, el Departamento de Rayos X utiliza un escáner de corte CT-16 Philips Brillaince Diamond Select® (Koninklijke Philips N.V., Países Bajos) con un sistema de alto rendimiento y una técnica helicoidal. Cada rebanada tenía un grosor de 0,625 mm para obtener la reconstrucción 2D y 3D. La administración de contraste se realizó con un bolo de 60 ml con 300 mg / ml y una velocidad de flujo de 4 ml / s.
Recopilación de datos
Para cada paciente, se recopilaron datos relacionados con: género, edad y factores de riesgo que incluyeron el uso reciente de anticonceptivos orales (AO), embarazo / puerperio, infección sinusal y diagnóstico de trombofilia en pacientes. También se recogió información sobre manifestaciones clínicas como alteración de la conciencia, cefalea, convulsiones, disartria, paresis, vértigo y deficiencias visuales. Hallazgos en el examen neurológico entre ellos conciencia deprimida, papiledema; Se documentaron oftalmoparesis y paresia de extremidades.
Además, se obtuvieron datos sobre el tiempo transcurrido entre la manifestación inicial y el diagnóstico definitivo y también se registraron los principales hallazgos en la tomografía computarizada del cerebro sin contraste y la VTC, el tratamiento de anticoagulación empleado (enoxaparina versus warfarina), así como la terapia anticonvulsiva utilizada. Además, se enumeraron las principales complicaciones hospitalarias (neumonía, infección del tracto urinario, estado convulsivo, necesidad de cirugía descompresiva y derivación lumbo-peritoneal), los resultados clínicos de 6 meses según la ERm y la mortalidad hospitalaria.
Investigaciones de laboratorio
Se analizaron el recuento de glóbulos blancos y de plaquetas, hemoglobina, tiempo de protrombina basal, tiempo de tromboplastina parcial activada y la Relación Normalizada Internacional (INR) para cada paciente. La química del suero, incluido el azúcar en ayunas, el nitrógeno ureico en sangre, la creatinina sérica, la bilirrubina, la transaminasa, la proteína, la albúmina y los electrolitos séricos también se documentaron. Además, se analizaron las pruebas de trombofilia con anticuerpos antinucleares (ANA), Anticuerpos anti-DNA doble cadena, anticuerpos antifosfolípidos, anticoagulante lúpico, proteína C, proteína S, mutación del factor V Leiden, mutaciones del gen de antitrombina III y polimorfismos del gen MTHRF.
Tratamiento
El tratamiento con heparina de bajo peso molecular (HBPM, enoxaparina) se inició inmediatamente después de establecer el diagnóstico de TSVD. Se utilizó la dosis estándar para la anticoagulación completa (1 mg / kg cada 12 horas por vía subcutánea).
Después del tratamiento inicial con HBPM, algunos pacientes fueron cambiados a warfarina durante al menos 6 meses, con el objetivo de obtener un valor de INR entre 2 y 3.
Los pacientes que se manifestaron con convulsiones recibieron tratamiento antiepiléptico con fenitoína con una dosis inicial de 20 mg / kg IV, seguido de 300 mg /dPO.
Resultado clínico
El resultado clínico se midió 6 meses después del alta de los pacientes con la ERm: 0 Sin síntomas.1 - Sin discapacidad significativa. Capaz de realizar todas las actividades habituales, a pesar de algunos síntomas. 2 - Discapacidad leve. Capaz de realizar sus propios asuntos sin ayuda, pero no puede realizar todas las actividades anteriores. 3 - Discapacidad moderada. Requiere un poco de ayuda, pero es capaz de caminar sin ayuda. 4 - Discapacidad moderadamente grave. No puede atender sus propias necesidades corporales sin ayuda, y no puede caminar sin ayuda. 5 - Discapacidad severa. Requiere cuidados y cuidados de enfermería constantes, postrado en cama, incontinente y 6 - muerto.
RESULTADO
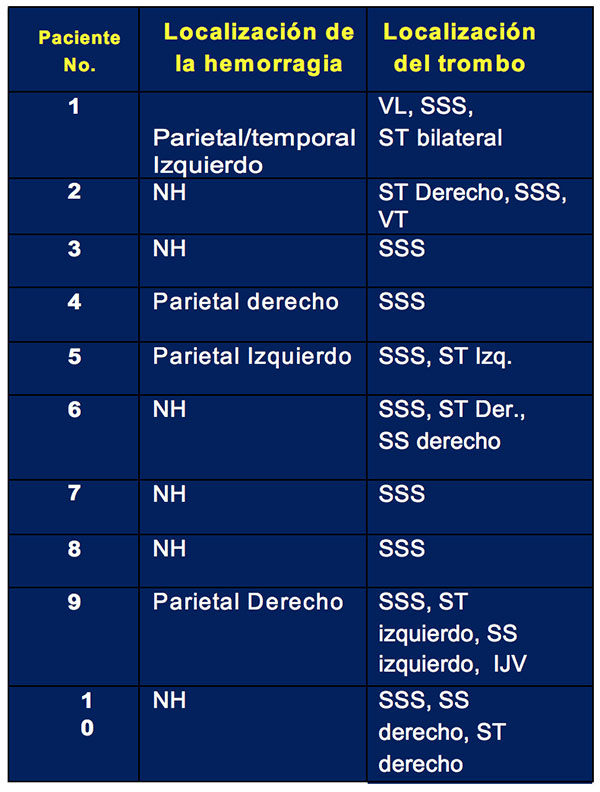
Se inscribieron 10 pacientes; todas ellas eran mujeres con una edad media de 31 ± 6,7 años. Cuatro de las pacientes estaban usando AO, con un tiempo promedio de uso de 1 a 3 meses antes del evento TSVD. Ningún caso se relacionó con embarazo / puerperio o sinusitis. Tres casos tuvieron una mutación genética del MTHRF (pacientes 1, 6 y 7). El paciente 7 también tenía un factor V de mutación de Leiden. No se encontraron otras trombofilias. Las manifestaciones clínicas incluyeron dolor de cabeza (10 pacientes), convulsiones (4 pacientes), conciencia deprimida (3 casos), deficiencias visuales (3 pacientes) y vértigo (2 pacientes). Examen neurológico documentado: papiledema bilateral (3 pacientes), paresia de extremidades (3 pacientes) y oftalmoparesia (1 paciente). El tiempo medio transcurrido entre los síntomas clínicos iniciales y el diagnóstico definitivo fue de 9 días (RIC ÷ 7-18 días). La Tabla No. 1 muestra la ubicación de la hemorragia cerebral parenquimatosa en el TC cerebral sin contraste y oclusión del seno venoso en la VTC.
Todas las pacientes tenían una trombosis del seno sagital superior (SSS), mientras que el seno transverso (ST) fue el segundo seno venoso más afectado. La mitad de las pacientes tenían trombos en más de un seno venoso. Todas las pacientes fueron tratadas con HBPM, cuatro de ellas fueron cambiadas a warfarina durante su hospitalización y seis continuaron el tratamiento con enoxaparina. La anticoagulación se continuó durante al menos 6 meses. Después de eso, la anticoagulación se detuvo en todas las pacientes. Sin embargo, la paciente 7 se mantuvo con warfarina debido al reporte de una doble trombofilia.
Tabla No. 1. Principales hallazgos en la tomografía computarizada del cerebro sin contraste y VTC
Hubo complicaciones hemorrágicas asociadas con la terapia de anticoagulación. Una de las pacientes desarrolló un papiledema bilateral que resultó en ceguera permanente (Figura No. 1), después de no mostrar mejoría ni con el uso de acetazolamida ni con una derivación lumbar-peritoneal colocada para reducir la hipertensión intracraneal. Cuatro pacientes tuvieron convulsiones como manifestación clínica inicial durante las dos primeras semanas. Todos ellos fueron tratados con fenitoína.
La Tabla No. 2 muestra las complicaciones en el hospital y el resultado clínico medido con la ERm. La mayoría de las pacientes tuvieron un buen resultado clínico y no se registraron muertes.
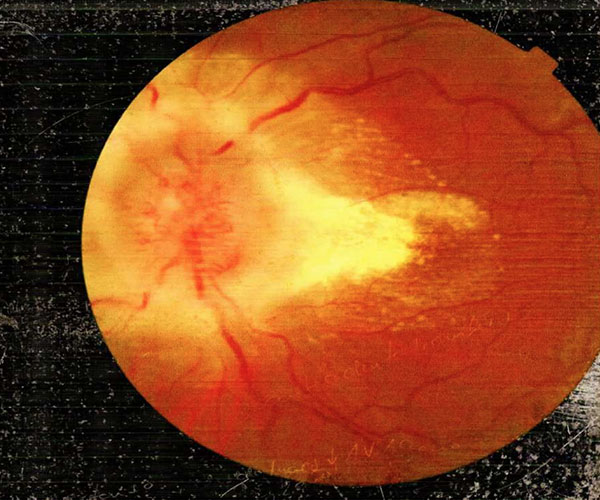
Figura No. 1. Paciente 7. Fondo de ojo con ojo izquierdo que muestra papiledema grado IV caracterizado por pérdida de vasos principales alrededor del disco óptico. Este paciente desarrolló una HIC refractaria con ceguera bilateral. Se colocó una derivación lumboperitoneal sin obtener una mejoría visual.
Tabla No. 2. Complicaciones en el hospital y resultado clínico a los 6 meses.
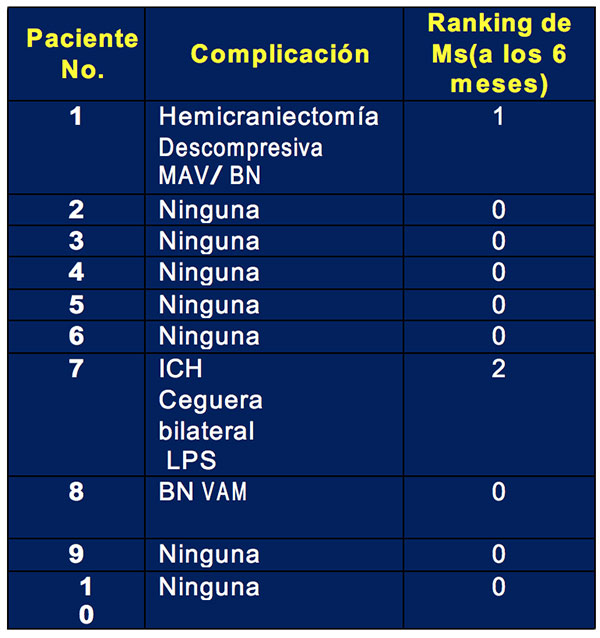
LPS indica derivación lumbo-peritoneal; HIC: hipertensión intracraneal;
AMV: ventilación mecánica asistida; BN: bronconeumonía.
DISCUSIÓN
En este análisis todos los pacientes afectados fueron mujeres. El uso reciente de AO y trombofilia (mutación genética del MTHRF y mutación del factor V Leiden) fueron los dos factores de riesgo principales asociados con la TSVD. Se sabe que el uso reciente de AO aumenta el riesgo de desarrollar un TSVD [6]. Se ha descrito que los AO aumentan la actividad de la mayoría de los factores hemostáticos, lo que lleva a la trombosis sistémica [7]. Este riesgo es mayor cuando la paciente que usa un AO también tiene una condición protrombótica inherente [8]. Se encontraron tres pacientes con una mutación en el gen MTHRF. Una paciente tenía una mutación en el gen del factor V Leiden, que es un trastorno trombofílico hereditario común. Este trastorno causa una resistencia a la proteína C activada, lo que aumenta el riesgo de TSVD [9]. Todos nuestros pacientes se quejaron de dolor de cabeza. El dolor de cabeza es una manifestación de un aumento de la presión intracraneal, debido al seno venoso ocluido. Alrededor del 90% de los pacientes con TSVD referirán dolor de cabeza [10].
En la TSVD, el dolor de cabeza generalmente se describe como generalizado y con frecuencia progresa en gravedad, durante días o semanas. Pocos presentan cefalea en trueno (que sugiera hemorragia subaracnoidea) o cefalea migrañosa [11]. Las convulsiones son una manifestación clínica común en la TSVD. Aproximadamente la mitad de los pacientes con TSVD tendrán convulsiones tempranas [12]. Las convulsiones pueden ser de tipo focal o generalizadas. Cuatro pacientes en este análisis tuvieron convulsiones tempranas.
Los pacientes con una lesión supratentorial hemorrágica que afecta a la región frontoparietal son más propensos a tener una convulsión [12]. Probablemente esto esté relacionado con un efecto irritante causado por la sangre en la superficie cortical. En este análisis, tres pacientes tenían una hemorragia parenquimatosa ubicada en la región parietal. Todas estas pacientes fueron tratadas con fenitoína. Si la paciente estuvo libre de convulsiones dos años después del episodio de TSVD, se suspendió la fenitoína. Puede ocurrir un empeoramiento neurológico después del diagnóstico de TSVD. Los pacientes con conciencia deprimida en el momento del ingreso tienen más probabilidades de deteriorarse [13]. Este empeoramiento neurológico podría estar relacionado con una nueva lesión hemorrágica parenquimatosa cuando se repite la neuroimagen. El déficit visual más común es la pérdida visual. La pérdida visual grave debido a TSVD rara vez ocurre [14]. La pérdida visual es más probable que ocurra en pacientes con papiledema y en aquellos que presentan un aumento de la presión intracraneal, como ocurrió con el paciente 7 en nuestro análisis (Figura No. 1).
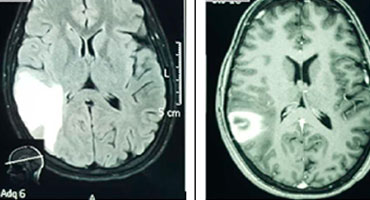
En este caso, la pérdida visual fue refractaria al tratamiento médico y quirúrgico. El papiledema provoca atrofia óptica y ceguera. El retraso en el diagnóstico de TSVD es común. La alta sospecha clínica es obligatoria para un diagnóstico temporano. En este análisis, el tiempo medio transcurrido entre los síntomas clínicos iniciales y el diagnóstico definitivo fue de 9 días. Se prefiere el uso de VTC para hacer el diagnóstico definitivo porque está disponible rápidamente y tiene una alta sensibilidad y especificidad para identificar el seno venoso afectado. La VTC es similar a MRV en el diagnóstico de TSVD [15]. La TC se usa comúnmente como prueba de neuroimagen inicial en pacientes con un diagnóstico clínico de TSVD. La TC cerebral sin contraste suele ser normal, pero puede tener hallazgos que sugieran TSVD [16], por ejemplo, la hiperatenuación de un seno dural. La hiperatenuación en los senos durales en las tomografías computarizadas de cerebro sin contraste tiene una alta precisión en la detección de trombosis sinusal cerebral aguda. Refleja un trombo recién formado [17]. La figura No.2 muestra algunos hallazgos sobre la tomografía computarizada del cerebro sin contraste y la VTC en nuestro análisis. La figura No. 3 muestra la relación entre una TC sin contraste y la RM en un caso de infarto venoso.
Todas las pacientes fueron tratadas con HBPM (enoxaparina) tan pronto como se estableció el diagnóstico de TSVD, utilizando las dosis estándar de anticoagulación. Según Misra et al, HBPM dio como resultado una mortalidad hospitalaria significativamente más baja en la TSVD en comparación con la heparina no fraccionada [18]. Además, HBPM tiene mayor duración de acción, tiene un efecto terapéutico más y no requiere monitorización de anticoagulante. Dependiendo de la causa de la trombosis sinusal, algunas pacientes fueron cambiadas a warfarina, un antagonista de la vitamina K (AVK). El uso de warfarina requirió el monitoreo de INR a menudo, además de que este medicamento tiene interacción farmacológica con muchos otros medicamentos o alimentos, lo que lleva a complicaciones hemorrágicas.
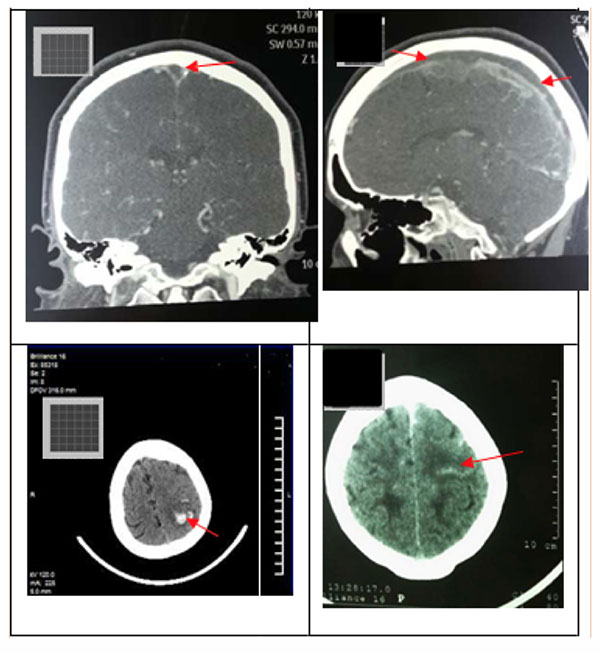
Figura No. 2. Principales hallazgos en la tomografía computarizada cerebral sin contraste VTC. A (coronal) y B (sagital) muestra un defecto de llenado extenso en el SSS secundario a un coágulo (flechas, paciente No. 6). C la TC (axial, sin medio de contraste) muestra una hemorragia parenquimatosa parietal izquierda (paciente nº 5). Este caso tuvo un SSS ocluido y dejó el ST. D (axial, sin medio de contraste) hiperdensidad lineal en el lóbulo parietal cortical izquierdo secundaria a un coágulo en una vena cortical ("signo de cordón", flecha) (paciente No. 8). Este caso tenía un SSS ocluido.
Recientemente, Geisbüsch et al informaron que un nuevo inhibidor del factor Xa (rivaroxaban) mostró beneficios clínicos similares a los de los AVK en el tratamiento de la TSVD [19]. Rivaroxaban podría ser un tratamiento alternativo deseable debido a su aplicación conocida, su metabolismo y su baja tasa de complicaciones hemorrágicas. Finalmente, la Tabla No. 2 muestra las complicaciones hospitalarias y el resultado clínico de todos los pacientes.
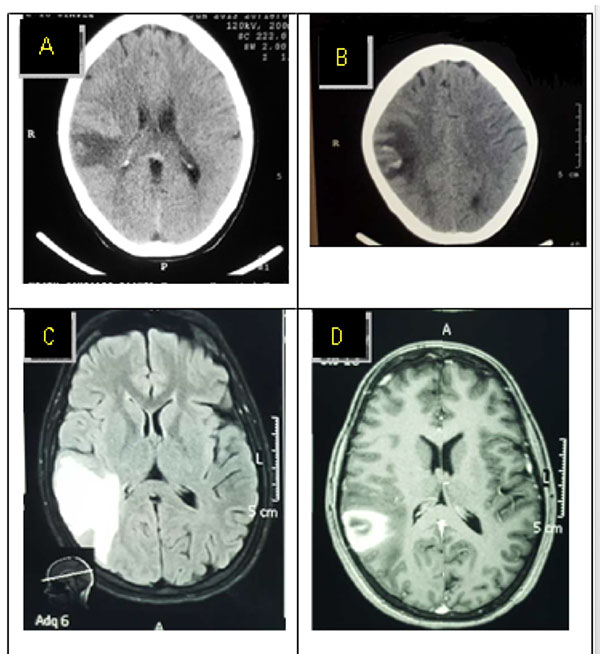
Figura No. 3. Paciente 4. La tomografía computarizada cerebral A, B (axial) sin contraste muestra una lesión parietal derecha hipodensa con una zona heterogénea centrada que corresponde a una hemorragia. La RM cerebral C (axial, FLAIR) muestra lesiones hiperintensas compatibles con edema secundario a un infarto venoso. D (axial, T1WI post Gd) muestra una zona con medio de contraste en la misma región. Este paciente tenía un SSS ocluido (no mostrado).
La hernia atribuible al efecto de masa unilateral es la principal causa de muerte en la TSVD. La paciente 1 desarrolló una gran lesión parieto-temporal parenquimatosa izquierda causada por hernia, que requirió de una hemicraniectomía descompresiva. El procedimiento quirúrgico se realizó como medida salva vidas. Una afección neurológica grave, como en estos casos, no debe desalentar la cirugía, porque al menos un tercio de estos pacientes puede tener una buena recuperación [20].
CONCLUSIONES
En este análisis de casos todas las pacientes afectadas fueron mujeres. El uso reciente de AO y trombofilia (mutación genética del MTHRF y mutación del factor V Leiden) fueron los dos factores de riesgo principales asociados con la TSVD. El seno ocluido más frecuente fue el SSS. El tiempo promedio transcurrido entre los síntomas clínicos iniciales y el diagnóstico definitivo fue de 9 días. Todos los pacientes fueron tratados con enoxaparina. Pocas de ellas fueron cambiadas a warfarina. Finalmente, la mayoría de las pacientes tuvieron un buen resultado clínico y no se registraron muertes.
APOYO DE FINANCIAMIENTO: Caja Costarricense de Seguro Social (CCSS)
DECLARACIÓN DE CONFLICTO DE INTERESES
No hay conflicto de intereses qué declarar.
REFERENCIAS
1. Bousser MG, Ferro JM. Cerebral venous thrombosis: an update. Lancet Neurol. 2007;6:162–170.
2. Ferro JM, Canha ̃o P, Stam J, Bousser MG, Barinagarrementeria F; ISCVT Investigators. Prognosis of cerebral vein and dural sinus thrombosis: results of the International Study on Cerebral Vein and Dural Sinus Thrombosis (ISCVT). Stroke. 2004;35:664–670.
3. Wasay M, Bakshi R, Bobustuc G, Kojan S, Sheikh Z, Dai A, Cheema Z. Cerebral venous thrombosis: analysis of a multicenter cohort from the United States. J Stroke Cerebrovasc Dis. 2008;17:49 –54.
4. Verma R, Sahu R, Lalla R. S. Subarachnoid haemorrhage as the initial manifestation of cortical venous thrombosis. BMJ. Case Reports 2012:bcr2012006498. Doi:10.1136/bcr-2012- 006498.
5. Bonneville F. Imaging of cerebral venous thrombosis. Diagnostic and Interventional Imagin. 2014; 95:1145-1150.
6. Martinelli I, Sacchi E, Landi G, Taioli E, Duca F, Mannucci PM. High risk of cerebral-vein thrombosis in carriers of a prothrombin-gene mutation and in users of oral contraceptives. N Engl J Med. 1998;338: 1793–1797.
7. Vandenbroucke JP,Rosing J,Bloemenkamp KW,et al. Medical progress: oral contraceptives and the risk of venous thrombosis. N Engl J Med. 344 (2001), pp. 1527-1535.
8. De Freitas GR, Bogousslavsky J. Risk factors of cerebral vein and sinus thrombosis. Front Neurol Neurosci. 2008;23:23–54.
9. Dentali F, Crowther M, Ageno W. Thrombophilic abnormalities, oral contraceptives, and risk of cerebral vein thrombosis: a meta-analysis. Blood. 2006;107:2766 –2773.
10. Khealani BA, Wasay M, Saadah M, Sultana E, Mustafa S, Khan FS, Kamal AK. Cerebral venous thrombosis: a descriptive multicenter study of patients in Pakistan and Middle East. Stroke. 2008;39:2707–2711.
11. Cumurciuc R, Crassard I, Sarov M, Valade D, Bousser MG. Headache as the only neurological sign of cerebral venous thrombosis: a series of 17 cases. J Neurol Neurosurg Psychiatry. 2005;76:1084 –1087.
12. Kalita J, Chandra S, Kant Misra U . Significance of seizure in cerebral venous sinus thrombosis. Seizure. 2012; 21: 639-642.
13. Crassard I, Canha ̃o P, Ferro JM, Bousser MG, Barinagarrementeria F, Stam J. Neurological worsening in the acute phase of cerebral venous thrombosis in ISCVT (International Study on Cerebral Venous Thrombosis). Cerebrovasc Dis. 2003;16(suppl 4):60. Abstract.
14. Baumgartner RW, Studer A, Arnold M, Georgiadis D. Recanalisation of cerebral venous thrombosis. J Neurol Neurosurg Psychiatry. 2003;74: 459–461.
15. Ozsvath RR, Casey SO, Lustrin ES, Alberico RA, Hassankhani A, Patel M. Cerebral venography: comparison of CT and MR projection venography. AJR Am J Roentgenol. 1997;169:1699 –1707.
16. Ford K, Sarwar M. Computed tomography of dural sinus thrombosis. AJNR Am J Neuroradiol. 1981;2:539 –543.
17. Buyck PJ, De Keyzer F, Vanneste D, Wilms G, Thijs V, Demaerel P. CT Density Measurement and H:H Ratio Are Useful in Diagnosing Acute Cerebral Venous Sinus Thrombosis. AJNR Am J Neuroradiol. 2013 Aug; 34:1568-72.
18. Misra UK, Kalita J, Chandra S, Kumar B, Bansal V. Low molecular weigth heparin versus unfractionated heparin in cerebral venous sinus thrombosis: a randomized controlled trial. European Journal of Neurology. 2012,19: 1030-1036.
19. Geisbüsch M, Richter D, Herweh C, Ringleb P, Nagel S. Novel Factor Xa Inhibitor for the Treatment of Cerebral Venous and Sinus Thrombosis First Experience in 7 Patients. Stroke. 2014;45:2469- 2471.
20. Ferro JM, Crassard I, Coutinho JM, Canhao Patrícia, Barinagagarrementeria F, Cucchiara Brett, et al. Decompressive Surgery in Cerebrovenous Thrombosis: A Multicenter Registry and a Systematic Review of Individual Patient Data. Stroke. 2011;42:2825-283.